1
في الكيمياء، توجد مصطلحات مختلفة لوصف بنية المادة، مثل الذرة مقابل الجزيء، الذرات هي لبنة البناء الأساسية لكل المادة ولا يمكن إنشاؤها، وتتكون من البروتونات والنيوترونات والإلكترونات، بينما يتكون الجزيء من ذرتين أو أكثر، سواء كانت من نفس النوع أم لا، عند التكسير، يُظهر كل جزيء الخصائص المحددة للمادة الكيميائية، وستناقش هذه المقالة الفرق بين الذرة والجزيء.
ما هو الفرق بين الذرة والجزيء
تعريف الذرة

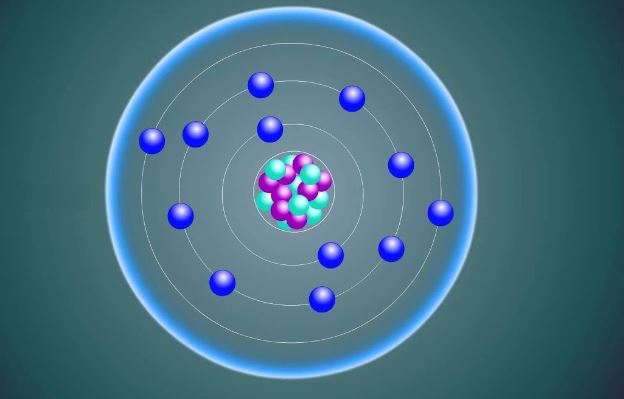
يشار إلى أصغر جسيم لمركب أو عنصر غير مرئي للعين المجردة بالذرة، ولكنه يشارك بشكل مباشر في التوليفات الكيميائية، بالإضافة إلى ذلك فهي تحتوي على إلكترون ونواة كما أنها كروية الشكل.
تتكون الذرة، وفقًا لنظرية رذرفورد، من نواة موجبة الشحنة محاطة بنظام من الإلكترونات سالبة الشحنة التي ترتبط ببعضها البعض بواسطة قوى جذب النواة. مجموع شحنات هذه الإلكترونات يعادل الشحنة الموجبة للنواة.
علاوة على ذلك، يُعتقد أن النواة تضم غالبية كتلة الذرة ولها أبعاد خطية صغيرة جدًا مقارنة بأبعاد الذرة بأكملها، ولقد تم تحديد أن الذرة لها نصف وزنها الذري في الإلكترونات.
النواة هي مركز الذرة ولا تتغير بشكل عام أثناء التفاعلات الكيميائية، باستثناء التفاعلات النووية، وهي مصنوعة من عدد متساوٍ من البروتونات والنيوترونات، العدد الذري يساوي عدد البروتونات وهذا الرقم يحدد العنصر، تتكون الكتلة الذرية من مجموع البروتونات والنيوترونات.
ما هي الإلكترونات
الإلكترونات أصغر بكثير وتدور حول النواة، الإلكترونات هي الجسيمات دون الذرية التي تشارك في التفاعلات الكيميائية وهي مسؤولة عن التغيرات في شحنة الذرة، أي ذرة تحتوي على عدد مختلف من الإلكترونات مقارنة بالبروتونات تسمى أيونًا .
يمكن أن تكون الأيونات سالبة إذا اكتسبت الذرة إلكترونًا يسمى الأنيون، أو يمكن أن تكون الأيونات موجبة إذا فقدت إلكترونًا يسمى الكاتيون.
اقرأ أيضا: ما هو الطيف الذري
الخصائص الذرية
- تحتوي الذرة على إلكترونات وبروتونات ونيوترونات.
- دائمًا ما يكون مركز الذرة عبارة عن بروتون موجب أو شحنة موجبة.
- جميع الذرات متعادلة كهربائيا.
- تم تقديم العديد من النظريات لإثبات شحنة الذرة.
- ذرة من نفس العنصر لها نفس عدد البروتونات والنيوترونات.
- حجم الذرة هو حجم نصف قطرها.
تعريف الجزيء

يوصف الجزيء بأنه اندماج ذرتين أو أكثر من نفس الذرات أو ذرات مختلفة مرتبطة ببعضها البعض بواسطة روابط كيميائية مختلفة.
يعتبر الجزيء هو أصغر جزء من مادة كما أنه يصور كل خاصية لتلك المادة المعينة، عندما يتم تكسير الجزيء، فإنه يظهر سمات العناصر المكونة منه. حتى عندما تنقسم المادة النقية إلى أجزائها الأصغر، يحتوي كل جزء على خصائص العناصر الرئيسية.
خصائص الجزيئات
- يمكن أن تكون الجزيئات صلبة أو سائلة أو غازية.
- للجزيئات نقطة انصهار منخفضة أو نقطة غليان عالية مقارنة بالمركبات الأيونية.
- يمكن للجزيئات إما أن تكون منخفضة الذوبان أو عالية الذوبان.
- الجزيئات موصلة رديئة للحرارة والكهرباء.
- في الجزيئات، ترتبط العديد من المواد الصلبة وتشكل بلورة شبكة مثل الماس.
- من أمثلة الجزيئات H2O ، N2 ، O3 ، CaO.
- بالمقارنة مع المواد الأيونية، تمتلك الجزيئات نقطة انصهار أقل أو نقطة غليان أعلى.
اقرأ أيضا: ما هو الزئبق ومن أين يستخرج
ما هو الفرق الرئيسي بين الذرة والجزيء
- الذرة هي أصغر جسيم من أي عنصر، في حين أن الجزيء هو أصغر جسيم في المركب.
- قد توجد الذرات أو لا تظهر بشكل مستقل بينما توجد الجزيئات بشكل مستقل.
- في الذرات، تتكون الجزيئات من الذرات بينما في الجزيئات تشكل الذرات الجزيء.
- قد تحتوي الذرات أو لا تحتوي على خصائص مادة بينما الجزيئات لها خصائص مادة.
- من أمثلة الذرات الهيدروجين والأكسجين والنيتروجين وما إلى ذلك، ومن أمثلة الجزيئات H2 و O2 إلخ.
- يمكن تقسيم الذرات إلى أنواع عديدة، في حين أن الجزيئات من نوعين فقط – جزيئات متجانسة ومتغايرة الذرات.
- ليس للذرات روابط بينما الجزيئات لها قوى بين الجزيئات وقوى داخل الجزيئية.
- الذرات شديدة التفاعل باستثناء الغازات النبيلة ، في حين أن الجزيئات أقل تفاعلًا.
- والجدير بالذكر أن الذرات شديدة التفاعل وتشارك في التفاعل الكيميائي بدون تحلل كيميائي، من ناحية أخرى، يكون الجزيء أقل تفاعلًا ولا يشارك في تفاعل كيميائي.
- بالإضافة إلى ذلك، تحتفظ الذرات بالرابطة النووية، لأنها تنطوي على التجاذب الكهروستاتيكي بين الإلكترون والنواة، على العكس من ذلك، تحتوي الجزيئات على روابط تساهمية مما يعني أنها تشترك في الإلكترونات مع بعضها البعض لتظل مرتبطة.
- يمكن للذرة أو لا يمكن أن توجد في حالة حرة، بينما من ناحية أخرى توجد الجزيئات في حالة حرة.
- تحتوي الذرة على نواة (مكونة من نيوترونات وبروتونات) وإلكترونات، بينما على العكس من ذلك، يتكون الجزيء من ذرتين أو أكثر من ذرات مختلفة أو متطابقة يتم دمجها كيميائيًا.
- شكل الذرة كروي، في حين أن شكل الجزيء يمكن أن يكون زاويًا أو مستطيلًا أو ثلاثيًا أو خطيًا.
هل يمكن تكوين الذرة
أضاف دالتون المفاهيم السابقة إلى السؤال السائد حول إنشاء ذرات العلب: أن جميع ذرات عنصر معين كانت متشابهة، وأن ذرات العنصر نفسه ستختلف في الكتلة والخصائص من النوى الذرية لعنصر آخر لا يمكن للذرات تكوينها، وتتولد هذه المادة عن طريق اندماج الذرات في أعداد كاملة عادية، لكن في وقت لاحق، أثبت بعض العلماء مثل توماسون أنه يمكن تقسيم الذرات.
تنص نظرية توماسون على أن الذرة تتكون من كرة كهربائية موجبة بشكل موحد تدور داخلها الإلكترونات في دائرة.
التمايز الرئيسي بين نماذج ذرة طومسون وروذرفورد هو حقيقة أن القوى التي تتصرف على الإلكترونات، في نموذج ذرة طومسون تسمح بتكوينات وحركة الإلكترونات عندما يكون الإطار في حالة مستقرة، ومع ذلك يبدو أن هذه التكوينات غائبة في نموذج ذرة رذرفورد.
كيف تصبح الذرة جزيئا
يعود تشكيل الذرة للجزئيات إلى تلك الجسيمات دون الذرية موجبة الشحنة سالبة الشحنة في الذرة، في حالة فقد بروتون أو إلكترون، يمكن أن تصبح الذرة سالبة أو موجبة الشحنة، عندما يحدث هذا، تصبح الذرة غير مستقرة.
الذرات مثل التوازن لذلك عندما تصبح الذرة سالبة أو موجبة الشحنة، فإنها يمكن أن تجذب بعضها البعض لتصبح متوازنة مرة أخرى، على سبيل المثال قد يتشاركون في الإلكترون لتكوين رابطة كيميائية .
يمكن أن يكون هذا رابطة واحدة كما في حالة الأمونيا (NH3)، ومع ذلك يمكن للجزيئات أيضًا تكوين روابط ثنائية وثلاثية .
تكسير الذرات والجزيئات
لا يمكن تكسير الذرات، ومع ذلك، نظرًا لأن الجزيئات تتكون من الذرات، يمكن تقسيم الجزيئات إلى ذرات فردية باستخدام تفاعلات كيميائية لكسر روابطها.
على سبيل المثال، يتكون الماء من الهيدروجين والأكسجين، لذلك يمكن تقسيم H2O إلى ذرات فردية باستخدام الكهرباء من خلال عملية تسمى التحليل الكهربائي .
#السعوودية #الامارات #الكويت #معلومة #نصيحة #فائدة
المراجع
مصدر1
مصدر2
مصدر3